もっと詳しく
柴田研究室の研究プラン
研究の概要
我々の研究室では、がん治療時に発生するDNA損傷とその修復反応を深く理解することを目標としています。特に放射線治療や化学療法を中心としたがん治療に着目し、「DNA修復」という視点から、がん治療の改善及び向上を目指しています。
放射線照射や一部の化学療法剤はDNAに損傷を引き起こします。その中でも二本鎖DNAを切断するタイプの損傷は、DNA二本鎖切断と呼ばれ、細胞の生死を決定しうる重篤なDNA損傷です。放射線・化学療法剤処理によって生じたDNA二本鎖切断が細胞内で修復されずにいると、細胞は細胞死を引き起こします。例えば放射線治療ではがん病巣部へ向けて放射線を照射することで、がん細胞内の二本鎖DNAを切断し、がん細胞を殲滅します。しかしながら、がん細胞と正常細胞の境界がはっきりと分別されているがんはほとんどなく、がん細胞と同時に正常細胞にもダメージを与えてしまうことが、副作用や二次性がんのリスクとなっています。また、がん細胞の中には放射線照射に対し耐性を示す細胞もあります。これらの細胞は後にがんの再発という問題を引き起こす可能性があります。放射線照射に対する耐性の違いは、患者個人が持つ遺伝的背景や、腫瘍の種類、がん細胞の遺伝子変異状態等、様々な要因があると考えられていますが、その詳細は未だ明らかになっていません。
我々は、正常細胞及びがん細胞内におけるDNA修復反応の詳細な分子メカニズムを解明することで、がん治療における副作用や二次性がんの軽減方法の発見、さらには最先端治療を含めたがん治療における新規増感方法の開発を目指しています。
なぜDNA修復研究が必要なのか?
近年のがん治療における技術的発達は著しい一方で、前述のように放射線・化学療法治療中に発生するDNA損傷への修復反応は未解明な部分が多く存在します。様々な遺伝的背景を持つがん細胞の中で起こるDNA修復反応は多種多様であり、それらがどのように制御されるかについては多くが明らかになっていません。また、DNA二本鎖切断と一言に言っても、X線、重粒子線、様々な化学療法剤の間では全く異なる形状のDNA二本鎖切断が生じます。そのため、DNA損傷の種類、さらには細胞が損傷を受けた時点での細胞内環境により、細胞はその都度適切なDNA修復経路を選択することが分かってきています。実際のところ、個々のDNA修復経路における反応機構は解明されつつありますが、異なる修復経路間の“連携”については不明な部分が多く残されています。そこで我々はDNA二本鎖切断に対する修復経路の使い分けに着目して研究を行っています。例えば、がん細胞はがん化の過程で多くの遺伝子変異が発生するため、DNA修復経路の一つが不活性化されている場合があります。そこでがん細胞は、自分自身が生存するためにその修復経路を諦め、別の経路を優先させていることがあります。我々の研究によってこれらDNA修復経路を操作(manipulation)することが出来れば、がん細胞内で不活性化している経路に再び戻すことによって、これまで放射線・化学療法剤処理に対して耐性であったがん細胞を再び高感受性にすることが出来ると考えます。上記は一例ですが、将来的な展望として基礎研究により得られた知見を活かすことでDNA修復反応全般を操作し、先進がん治療を含めた様々ながん治療法の改善及び向上に貢献することを目指しています。
プロジェクト1:細胞が選択する最適なDSB修復経路決定機構の解明
~~細胞はどのようにして最も適切なDNA修復経路を選ぶのか?~~
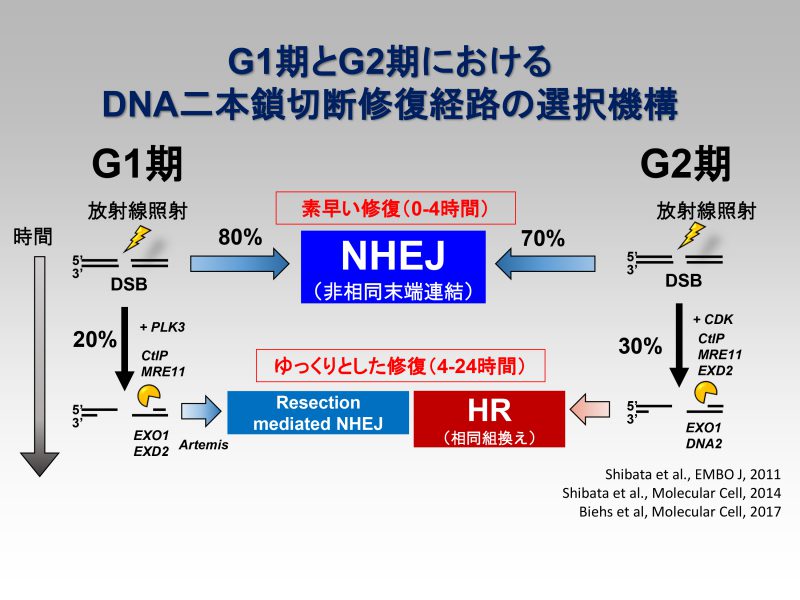
細胞内に生じたDNA二本鎖切断(DNA double strand break; DSB)は、NHEJ又はHRのどちらかにより修復されることが知られています。放射線照射によって発生したDSBに対し、細胞は何かしらの理由を持ってNHEJとHRを使い分けており、常に時と場合に応じて最も適切な判断を下していると考えられます。私たちの研究では、細胞がなぜ、どのようにして二つのDSB修復経路のうちの一つを選択するかを明らかにしたいと考えています。DSB修復経路選択メカニズムを解明することは経路選択を制御することにも繋がり、放射線や化学療法剤に対するがん細胞の感受性を高めることが出来ると考えています。
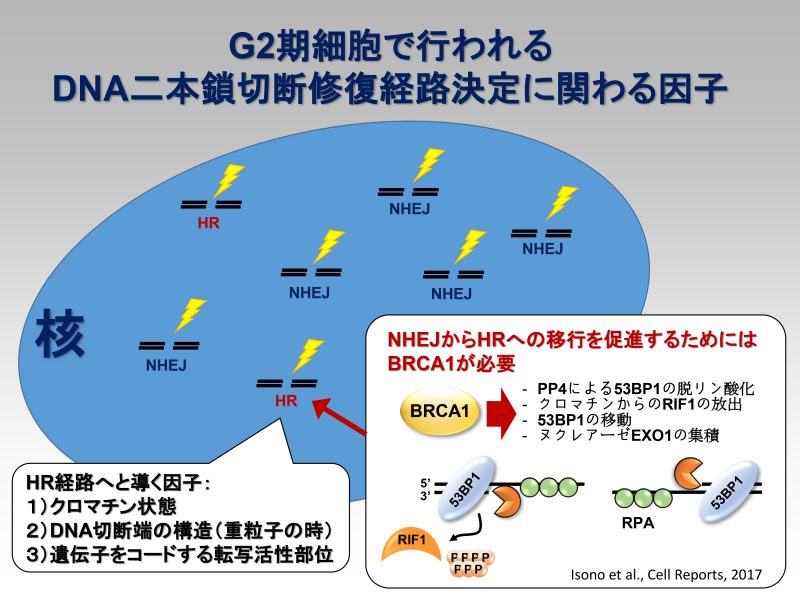
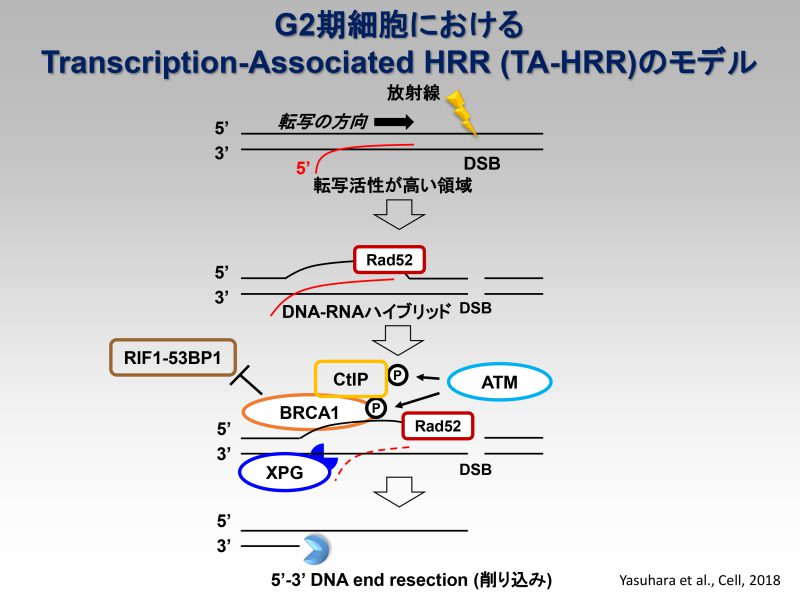
これまでの私たちの研究から、放射線照射によって発生したDSBはG2期であっても主にNHEJを用いてDSBを修復することが分かっています(Beucher et al., EMBO, 2009)。ただし、DSBが生じた部位でのクロマチン環境や、重粒子線の照射によって複雑な切断端を有していた場合には、HRを優先的に使うことが分かってきました(参考論文1)。これまでの実験結果から、私たちが提唱しているモデルでは、放射線照射で発生したDSBに対し、NHEJ修復因子がすべてのDSBに結合した後、NHEJで修復することが適切ではないと細胞が判断した場合に修復経路がNHEJからHRへと切り替わると考えています。さらにその切り替えには、HRの開始を導くDNA-end resectionに必要なCtIPや、MRE11のエンドヌクレアーゼ活性が必要であることを示しています(参考論文1, 2, 3)。また近年、私たちはBRCA1がPP4依存的な53BP1の脱リン酸化を介し、クロマチンからのRIF1の放出およびEXO1を集積させることで、HRへの切り替えを促進していることを見出し報告しています(参考論文4)。現在私たちは、NHEJからHRに修復経路が切り替わる際の「きっかけ」を分子レベルで明らかにしようと研究を進めています。このプロジェクトの最終目標として、NHEJとHRの使い分けを決定しているマスター因子を見つけ、それぞれの修復経路を自由自在に使い分けられる薬剤を開発し医療に貢献したいと考えています。
参考論文
- RAP80 suppresses the vulnerability of R-loops during DNA double-strand break repair
Cell Reports, 2022 - Rad52 Promotes XPG-Mediated R-loop Processing to Initiate Transcription-Associated Homologous Recombination Repair.
Cell, 2018 - BRCA1 Directs the Repair Pathway to Homologous Recombination by Promoting 53BP1 Dephosphorylation
Cell Reports, 2017 - DNA Double-Strand Break Resection Occurs during Non-homologous End Joining in G1 but Is Distinct from Resection during Homologous Recombination.
Molecular Cell, 2017 - DNA Double Strand Break Repair Pathway Choice Is Directed by Distinct MRE11 Nuclease Activities
Molecular Cell, 2014 - Factors determining DNA double-strand break repair pathway choice in G2 phase
EMBO J, 2011
プロジェクト2:DNA損傷によって引き起こされる免疫応答の解明
~~DNA損傷を受けてなお生き残ったがん細胞を免疫によって除去したい~~
DNA損傷によってがん細胞膜表面にあるNKG2Dリガンドが活性化されることが知られています(Gasser S, Nature, 2005)。NKG2Dリガンドはナチュラルキラー(NK)細胞によって認識され、NK細胞ががん細胞を除去します。私たちは、がん細胞のクロマチン環境変化によってDNA損傷後のNKG2Dリガンド発現量が変化することを見出しました(参考論文5)。
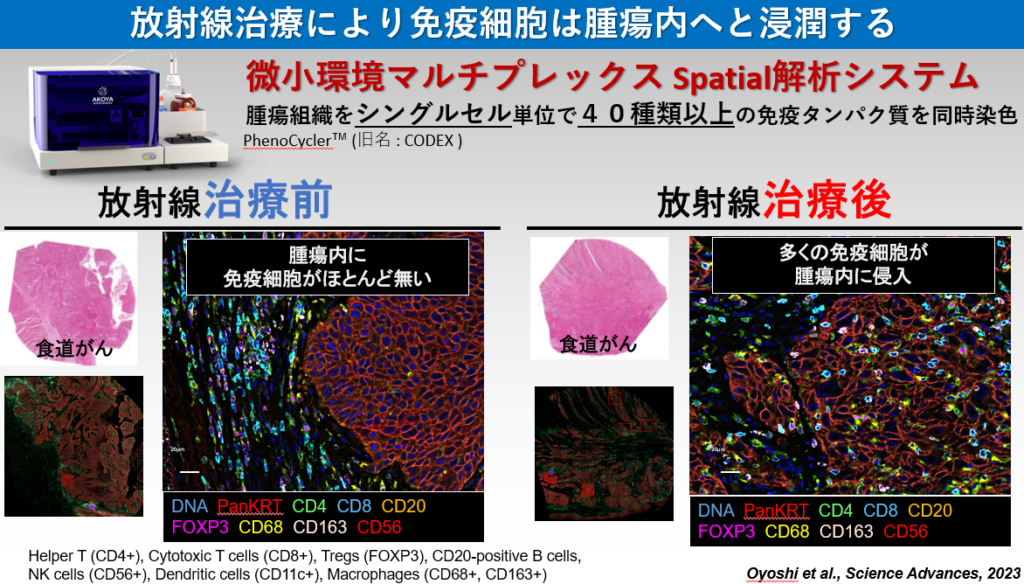
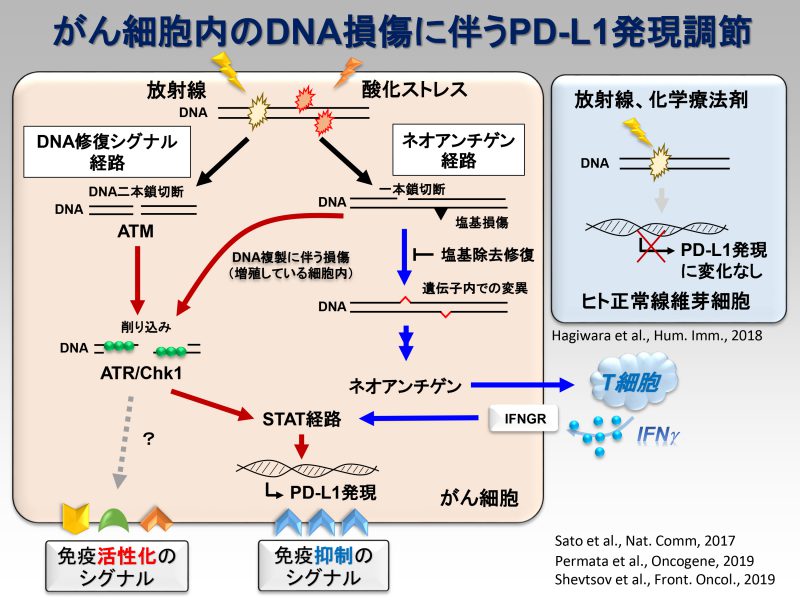
近年、抗PD-1/PD-L1抗体と呼ばれる免疫治療が大きな注目を集めています。抗PD-1抗体による優れた治療成績の報告が相次ぐ一方で、単剤治療のみでは効果が不十分なケースが存在するため、その最適な治療パートナーの選定が世界各国で進められています。放射線治療は抗PD-1抗体治療の弱点である固形がんに対しても有効性を示すため、両者併用による根治が期待されています。実際、抗PD-1抗体と放射線治療の併用療法は世界各国で臨床試験が開始されている状況です。私たちは、放射線照射によりがん細胞膜表面上のPD-L1発現が高まることを見出しました。またその発現上昇には、放射線誘発DNA二本鎖切断により活性化されるATM/ATR/Chk1が必要であることを発見しました。さらにDNA二本鎖切断に対して主要なDNA修復経路因子であるBRCA2とKu70/80が、放射線照射後のPD-L1発現上昇に関わること、さらにその詳細な分子機構を解明し、その研究成果を報告しています(参考論文3, 4)。DNA損傷により免疫抑制に働くPD-L1発現が高まる一方で、T細胞に対して抗原提示を行い免疫を活性化するHLA Class Iの提示も、DNA損傷で高まることを見出し報告しています(参考文献2)。また2023年には、国立がんセンター東病院の秋元先生らの研究グループと共同で、食道がんに対して放射線治療を行った患者さんの検体を用いてシングルセル解析を行った結果、超免疫抑制抑制型のマクロファージや樹状細胞が存在することを見出しました(参考文献1)。この発見は、がん細胞を殲滅するために必要不可欠な免疫を活性化するために重要な知見であると考えています。将来、確実に世界に広がるであろう放射線治療と抗PD-1抗体の併用治療時の分子機構を明らかにしていくことで、放射線免疫併用治療の有用性の証明、併用治療を最大限に活かす治療法の提案をしていきたいと考えています。
参考論文
- Comprehensive single cell analysis demonstrates radiotherapy-induced infiltration of macrophages expressing immunosuppressive genes into tumour in oesophageal squamous cell carcinoma
Science Advances, 2023 - DNA damage promotes HLA class I presentation by stimulating a pioneer round of translation-associated antigen production
Mol Cell, 2022 - Base excision repair regulates PD-L1 expression in cancer cells.
Oncogene, 2019. - DNA double-strand break repair pathway regulates PD-L1 expression in cancer cells.
Nature Communications, 2017 - Inhibition of the HDAC/Suv39/G9a pathway restores the expression of DNA damage-dependent major histocompatibility complex class I-related chain A and B in cancer cells.
Oncology Reports, 2017
プロジェクト3:DNA損傷可視化プロジェクト
~~超高解像度蛍光顕微鏡によって「傷の形」を目で見てみる~~
DNAの傷といっても、その形状は様々です。私たちは、世界最高レベルの超高解像度蛍光顕微鏡を使って、DNA損傷の形を可視化しようとしています。
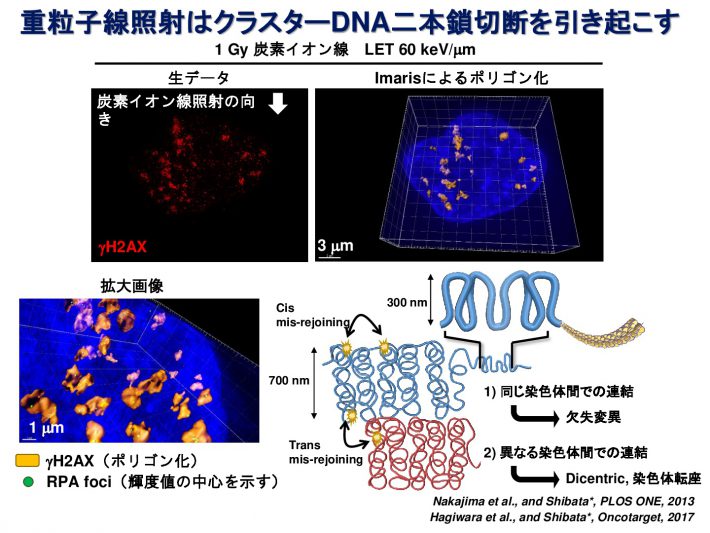
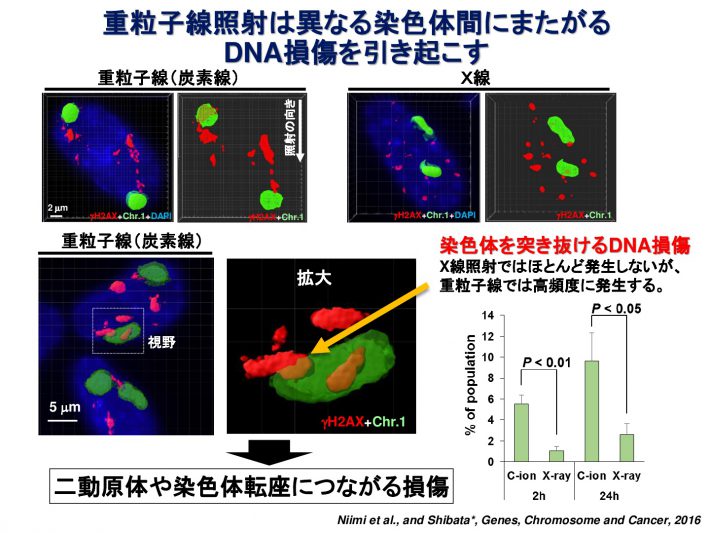
重粒子線は通常のX線とは異なり、非常に複雑な形態のDNA損傷を引き起こすと考えられています。私たちはDNA損傷マーカーであるgH2AXまたは53BP1フォーサイに対して高解像度蛍光顕微鏡で観察することにより、重粒子線照射によって生じたDNA損傷領域が、無数の小さなgH2AXフォーサイを有するクラスターであることを発見しました(参考論文1, 2)。また、重粒子線が染色体間の境界にも高頻度にDNA損傷を引き起こしやすいことを見出し報告しています(参考論文3)。さらに、詳細にDNA損傷部位を同定するため、3次元 構造化照明顕微鏡(Structured Illumination Microscopy;SIM)という方法を用いて、重粒子線照射によって1 μm3の範囲内に、平均700 nmの間隔をもって密集したDSBが生じていることを見出しました(参考論文4)。DNAの傷の形を正確に知ることで、どういった傷が、がん細胞を効果的に殺傷できるのか明らかになると考えています。
参考論文
- Quantitative volumetric analysis of the Golgi apparatus following X-ray irradiation by super-resolution 3D-SIM microscopy.
Medical Molecular Morphology, 2021. - 3D-structured illumination microscopy reveals clustered DNA double-strand break formation in widespread γH2AX foci after high LET heavy-ion particle radiation.
Oncotarget, 2017 - Identification of DNA Double Strand Breaks at Chromosome Boundaries Along the Track of Particle Irradiation.
Genes, Chromosomes and Cancer, 2016. - Visualisation of gH2AX Foci Caused by Heavy Ion Particle Traversal; Distinction between Core Track versus Non-Track Damage
PLOS ONE, 2013 - Identification of DNA Double Strand Breaks at Chromosome Boundaries Along the Track of Particle Irradiation.
Genes, Chromosomes and Cancer, 2016. - Visualization of complex DNA double-strand breaks in a tumor treated with carbon ion radiotherapy
Scientific Reports, 6:22275, 2016. - Identification of DNA Double Strand Breaks at Chromosome Boundaries Along the Track of Particle Irradiation.
Genes, Chromosomes and Cancer, 2016.