簡単に
研究テーマ
体の設計図と呼ばれるDNAが傷ついたときに、どうやって人はその傷を治すのか、「DNA修復」の仕組みを研究しています。
講座紹介動画
DNAの傷や修復を研究すると、何の役に立つ?
実は私たちのDNAは日々傷ついています。その傷をきちんと治せないと体の設計図がごちゃごちゃになってしまいます。実際、DNAが何度も間違って治されてしまうと、がん、免疫異常、神経疾患などの病気、また老化が進むことが分かっています。そのため、DNAをきちんと治せる仕組みを知ることは、これらの病気の予防、そして健康増進につながります。わたしたちは、特にがんを対象として研究を行っています。がんがどうして出来るのか、発がんの原因が分かれば、きちんと予防できるはずです。
一方、がん治療では、わざとがん細胞のDNAに傷をつけてがん細胞を殺します。放射線治療や化学療法と呼ばれる治療法です。がん細胞がどうやってDNAを修復し、生き残ってしまうかの仕組みを知ることができれば、その修復を止める方法を使って、より効果的な治療方法を開発できると考えています。
どんなことをしている? 実際のところ、実験って何?
こちらの実験機器を使って(実験機器一覧)、いわゆる「分子生物学」の実験をしています。分子生物学とは、細胞の中の出来事を、分子のレベルで研究することです。おもに、培養細胞を使います。
培地(栄養入り)が入ったフラスコまたはディッシュ(プラスチックの容器やお皿)の底に、細胞がくっついています


X線照射装置に、細胞が入ったお皿を入れます


*ドアを閉めて、スイッチを押したときだけX線が照射されるため、安全です。
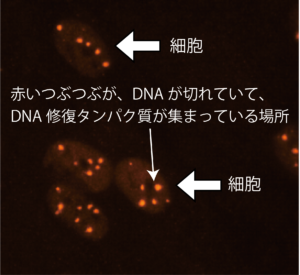
培養細胞にX線を照射してDNAに傷をあたえて、DNAの傷に集まるタンパク質の解析をします。蛍光免疫染色という技術を使うと、蛍光顕微鏡を使ってDNA修復タンパク質の集積を見ることが出来ます。
このような技法を使うことによって、たくさんのDNA修復タンパク質が、いつどのようなタイミングで、そしてどのような秩序で集まってきているのかを観察します。
その後、ラボミーティングでの発表や、論文発表、学会発表用に、パワーポイントにまとめます
論文って何でしょうか?
私たちは実験を行った後、データを整理し、同じ実験をやって同じ結果が出るかを確認します。それらの結果から現時点で考え得るベストな仮説を立てます。そして、「こんなデータがでたので、こんなことが起こっているだろう」と結論づけます。
ではその実験結果は、自分のパソコンの中にだけ入れていてもよいのでしょうか。いいえ、その実験結果を世界中の人に知ってもらうために、英語で実験結果をまとめることが必要です。それが論文です。
ただ実はここからが研究者の大変なところ醍醐味ですが、論文を発表するために、論文を雑誌社(有名な雑誌はNature, Cell, Scienceなど)に送ります。雑誌社の編集長は、僕らが書いた論文では実験が正しく行われているか、実験データの解釈が正当かどうか、その分野の専門家2-3人に評価を依頼します。これらの評価者は匿名なので、僕らは誰が評価しているか分かりません。そして評価者から辛辣ありがたいコメントをいただき、評価者が納得してくれるように追加実験や文章の修正を行います。
そして全ての評価者に納得していただいて、ようやく雑誌社に僕たちの研究成果が論文として掲載されます。
業績って聞くけど何が大事? 論文を発表すると何が起きる?
英語で論文を発表しますので、結果的に世界中の研究者が論文のデータを見ることができます。現在はオンラインがほとんどですが、オンラインであっても書籍化されるということは、人類の文明が続く限り、ずっと残る人類の知的財産となります。生物に関わる発見であれば、その論文を参考にして、生物の教科書が書き換わるかもしれません。また、その発見をもとに新たにどこかの国の研究者、または大学院生が研究をスタートさせるかもしれません。医療に関わる発見であれば、新しい薬の開発が始まるかもしれません。その発見によって病気の原因が分かることで、不治の病だと言われていた方に治療方法の希望を見出すことができるかもしれません。このように、論文を発表することで世界中の科学に影響を与えることができるのです。
学会って何でしょうか?
論文発表の内容を整理し、僕たちの実験結果を大きなスクリーンを使って研究者たちの前で発表します。国内の学会は日本からの参加者がほとんどですが、国際学会では世界中の人が参加します。100人、200人、時にはそれ以上の大きな会場で発表することで、一度に多くの研究者に向けて自分たちの研究成果を発表することができます。論文を雑誌社に送ったときのように、時にはその分野をリードする世界トップレベルの方々から辛辣ありがたいコメントをいただくこともあるかもしれません。ただ、そのように面と向かってお互いが議論し切磋琢磨することは、サイエンスのレベルを高めるためにとても重要なことです。
DNA修復学研究室(柴田ラボ)って?
こちらのページを読んでいただいた方は、生物研究について、またDNA修復学研究室(柴田ラボ)の研究内容、そして雰囲気を感じ取っていただけたのではないかと思います。「科学」と言っても実は様々で、日本ではよく「科学技術」という言葉が用いられます。私は「科学」と「技術」は別々の言葉だと思っていて、科学は新しい概念、つまり今まで誰も思いもしなかった考え方を生み出すことだと思っています。例えば、地球は丸い、物体には重力がある、体は細胞からできている、細胞の中にはDNAがある、です。一方で技術は、何か新しい物を作り上げることであり、今まで出来なかったことができます。例えば、最新の望遠鏡でブラックホールを観察したり、超解像顕微鏡で細胞の中のDNAを観察したり、です。新しい概念は思いついただけでは不十分で、立証することが必要です。それぞれの時代で革新的な技術が生まれ、その技術を使って誰かが考えた新しい概念が証明されます。このように、科学と技術は両輪として働くことによって、本当の意味での科学(サイエンス)が発展すると私は考えています。
DNA修復学研究室では、柴田の師であるイギリスのJeggo教授から受け継いだ「新しい概念を提示するための研究」を行っています。そのため、自ら新しい技術を開発するというよりは、同じ時代を生きる研究者が開発した新しい技術を臨機応変かつ適材適所で導入し、自らの仮説を証明するといったスタイルで研究を行っています。Jeggo教授は、DNA修復には非相同末端連結と呼ばれる修復経路があることを提唱し、そこで働くDNA-PKという分子を発見しました。さらに、DNA修復が、免疫細胞が多様性を獲得するための反応に関わることを世界で初めて発見し、その概念を提唱しました。Jeggo教授からの影響が大いにあると思いますが、柴田ラボでは、人の体で起こっているDNA修復の仕組みについて、「あ、実はこんな風な仕組みになってたんだ」という発見をして、全世界に向け、新しい概念を提唱することを目指しています。世界の誰よりも早く気づき、それを実験で証明して、そしてその情報を論文として全世界の方々に配信する、という流れですね。
最後まで読んでいただいた方、誠にありがとうございました。最後まで読んでいただけたのであれば、きっとDNA修復、そして柴田ラボのことに興味を持っていただけたはずです、ぜひ一緒に研究しましょう。
もっと詳しく
柴田研究室の研究プラン
研究の概要
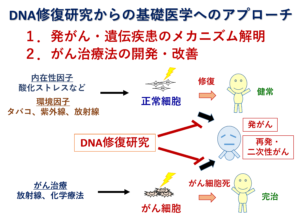
我々の研究室では、がん治療時に発生するDNA損傷とその修復反応を深く理解することを目標としています。特に放射線治療や化学療法を中心としたがん治療に着目し、「DNA修復」という視点から、がん治療の改善及び向上を目指しています。
放射線照射や一部の化学療法剤はDNAに損傷を引き起こします。その中でも二本鎖DNAを切断するタイプの損傷は、DNA二本鎖切断と呼ばれ、細胞の生死を決定しうる重篤なDNA損傷です。放射線・化学療法剤処理によって生じたDNA二本鎖切断が細胞内で修復されずにいると、細胞は細胞死を引き起こします。例えば放射線治療ではがん病巣部へ向けて放射線を照射することで、がん細胞内の二本鎖DNAを切断し、がん細胞を殲滅します。しかしながら、がん細胞と正常細胞の境界がはっきりと分別されているがんはほとんどなく、がん細胞と同時に正常細胞にもダメージを与えてしまうことが、副作用や二次性がんのリスクとなっています。また、がん細胞の中には放射線照射に対し耐性を示す細胞もあります。これらの細胞は後にがんの再発という問題を引き起こす可能性があります。放射線照射に対する耐性の違いは、患者個人が持つ遺伝的背景や、腫瘍の種類、がん細胞の遺伝子変異状態等、様々な要因があると考えられていますが、その詳細は未だ明らかになっていません。
我々は、正常細胞及びがん細胞内におけるDNA修復反応の詳細な分子メカニズムを解明することで、がん治療における副作用や二次性がんの軽減方法の発見、さらには最先端治療を含めたがん治療における新規増感方法の開発を目指しています。
なぜDNA修復研究が必要なのか?
近年のがん治療における技術的発達は著しい一方で、前述のように放射線・化学療法治療中に発生するDNA損傷への修復反応は未解明な部分が多く存在します。様々な遺伝的背景を持つがん細胞の中で起こるDNA修復反応は多種多様であり、それらがどのように制御されるかについては多くが明らかになっていません。また、DNA二本鎖切断と一言に言っても、X線、重粒子線、様々な化学療法剤の間では全く異なる形状のDNA二本鎖切断が生じます。そのため、DNA損傷の種類、さらには細胞が損傷を受けた時点での細胞内環境により、細胞はその都度適切なDNA修復経路を選択することが分かってきています。実際のところ、個々のDNA修復経路における反応機構は解明されつつありますが、異なる修復経路間の“連携”については不明な部分が多く残されています。そこで我々はDNA二本鎖切断に対する修復経路の使い分けに着目して研究を行っています。例えば、がん細胞はがん化の過程で多くの遺伝子変異が発生するため、DNA修復経路の一つが不活性化されている場合があります。そこでがん細胞は、自分自身が生存するためにその修復経路を諦め、別の経路を優先させていることがあります。我々の研究によってこれらDNA修復経路を操作(manipulation)することが出来れば、がん細胞内で不活性化している経路に再び戻すことによって、これまで放射線・化学療法剤処理に対して耐性であったがん細胞を再び高感受性にすることが出来ると考えます。上記は一例ですが、将来的な展望として基礎研究により得られた知見を活かすことでDNA修復反応全般を操作し、先進がん治療を含めた様々ながん治療法の改善及び向上に貢献することを目指しています。
プロジェクト1:細胞が選択する最適なDSB修復経路決定機構の解明
~~細胞はどのようにして最も適切なDNA修復経路を選ぶのか?~~
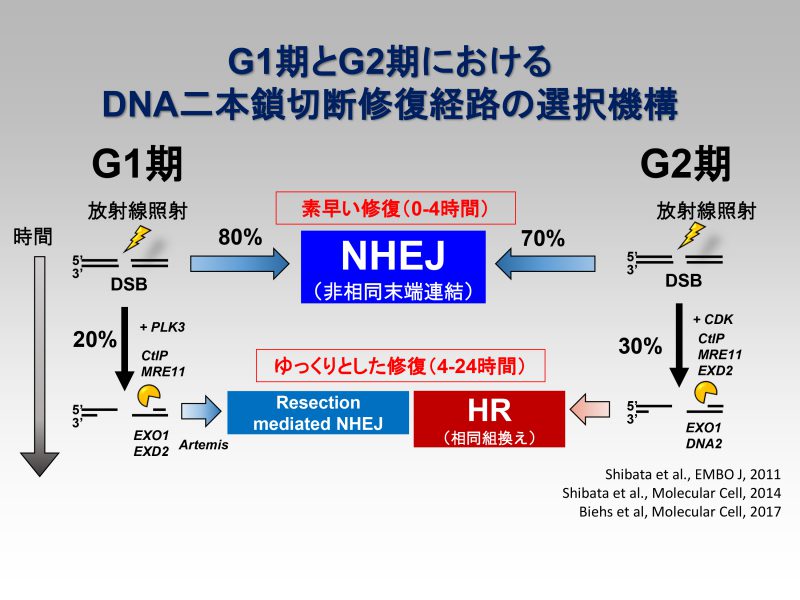
細胞内に生じたDNA二本鎖切断(DNA double strand break; DSB)は、NHEJ又はHRのどちらかにより修復されることが知られています。放射線照射によって発生したDSBに対し、細胞は何かしらの理由を持ってNHEJとHRを使い分けており、常に時と場合に応じて最も適切な判断を下していると考えられます。私たちの研究では、細胞がなぜ、どのようにして二つのDSB修復経路のうちの一つを選択するかを明らかにしたいと考えています。DSB修復経路選択メカニズムを解明することは経路選択を制御することにも繋がり、放射線や化学療法剤に対するがん細胞の感受性を高めることが出来ると考えています。
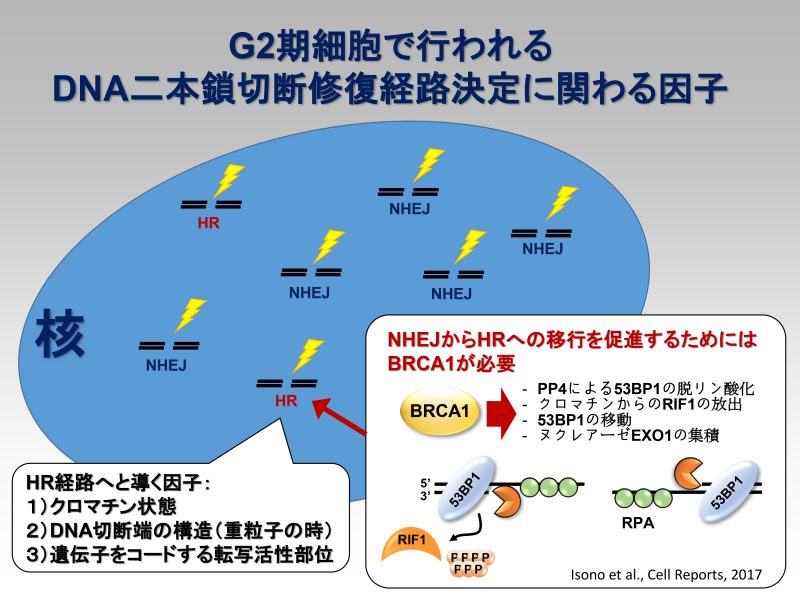
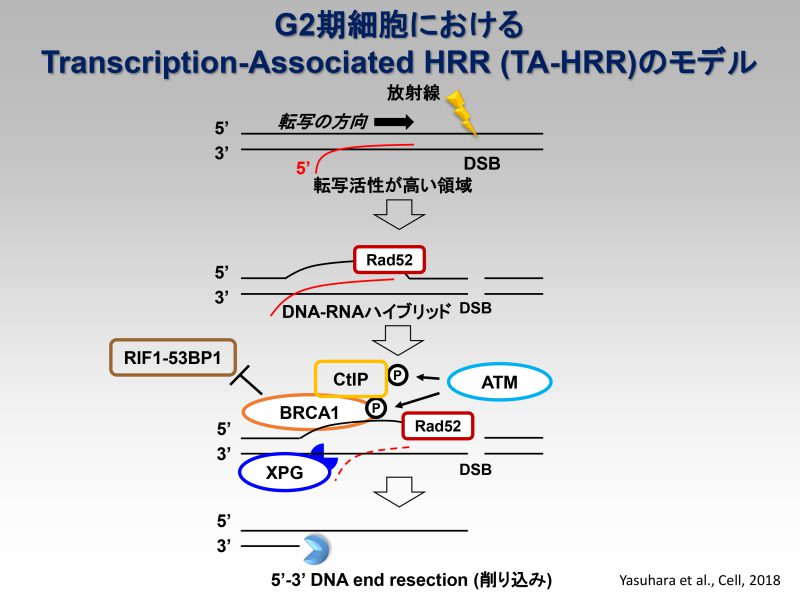
これまでの私たちの研究から、放射線照射によって発生したDSBはG2期であっても主にNHEJを用いてDSBを修復することが分かっています(Beucher et al., EMBO, 2009)。ただし、DSBが生じた部位でのクロマチン環境や、重粒子線の照射によって複雑な切断端を有していた場合には、HRを優先的に使うことが分かってきました(参考論文1)。これまでの実験結果から、私たちが提唱しているモデルでは、放射線照射で発生したDSBに対し、NHEJ修復因子がすべてのDSBに結合した後、NHEJで修復することが適切ではないと細胞が判断した場合に修復経路がNHEJからHRへと切り替わると考えています。さらにその切り替えには、HRの開始を導くDNA-end resectionに必要なCtIPや、MRE11のエンドヌクレアーゼ活性が必要であることを示しています(参考論文1, 2, 3)。また近年、私たちはBRCA1がPP4依存的な53BP1の脱リン酸化を介し、クロマチンからのRIF1の放出およびEXO1を集積させることで、HRへの切り替えを促進していることを見出し報告しています(参考論文4)。現在私たちは、NHEJからHRに修復経路が切り替わる際の「きっかけ」を分子レベルで明らかにしようと研究を進めています。このプロジェクトの最終目標として、NHEJとHRの使い分けを決定しているマスター因子を見つけ、それぞれの修復経路を自由自在に使い分けられる薬剤を開発し医療に貢献したいと考えています。
参考論文
- RAP80 suppresses the vulnerability of R-loops during DNA double-strand break repair
Cell Reports, 2022 - Rad52 Promotes XPG-Mediated R-loop Processing to Initiate Transcription-Associated Homologous Recombination Repair.
Cell, 2018 - BRCA1 Directs the Repair Pathway to Homologous Recombination by Promoting 53BP1 Dephosphorylation
Cell Reports, 2017 - DNA Double-Strand Break Resection Occurs during Non-homologous End Joining in G1 but Is Distinct from Resection during Homologous Recombination.
Molecular Cell, 2017 - DNA Double Strand Break Repair Pathway Choice Is Directed by Distinct MRE11 Nuclease Activities
Molecular Cell, 2014 - Factors determining DNA double-strand break repair pathway choice in G2 phase
EMBO J, 2011
プロジェクト2:DNA損傷によって引き起こされる免疫応答の解明
~~DNA損傷を受けてなお生き残ったがん細胞を免疫によって除去したい~~
DNA損傷によってがん細胞膜表面にあるNKG2Dリガンドが活性化されることが知られています(Gasser S, Nature, 2005)。NKG2Dリガンドはナチュラルキラー(NK)細胞によって認識され、NK細胞ががん細胞を除去します。私たちは、がん細胞のクロマチン環境変化によってDNA損傷後のNKG2Dリガンド発現量が変化することを見出しました(参考論文5)。
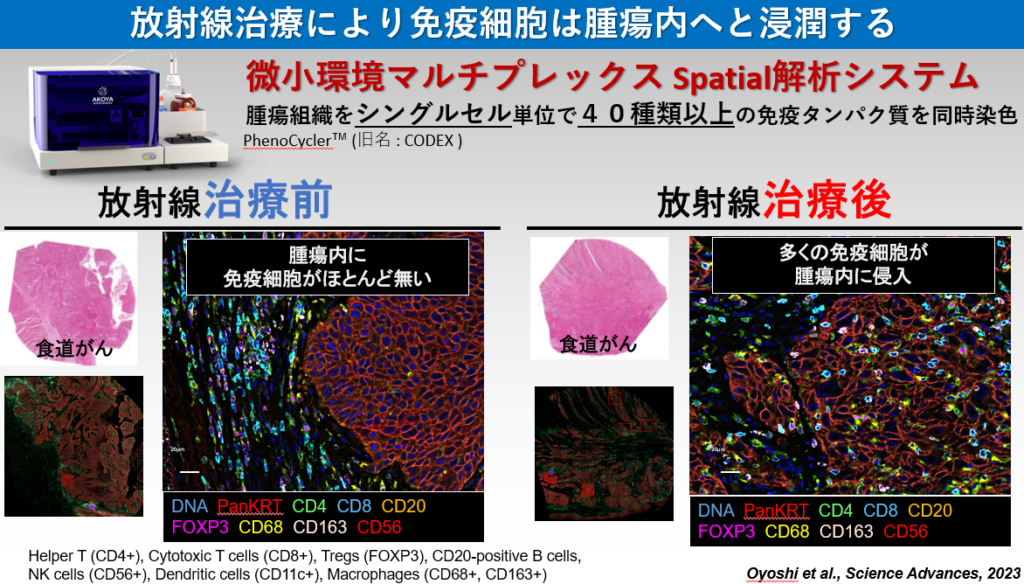
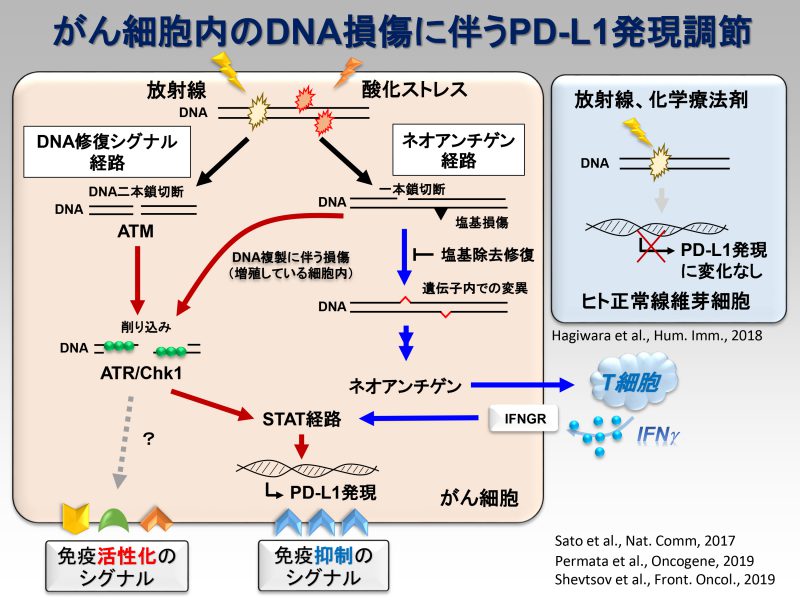
近年、抗PD-1/PD-L1抗体と呼ばれる免疫治療が大きな注目を集めています。抗PD-1抗体による優れた治療成績の報告が相次ぐ一方で、単剤治療のみでは効果が不十分なケースが存在するため、その最適な治療パートナーの選定が世界各国で進められています。放射線治療は抗PD-1抗体治療の弱点である固形がんに対しても有効性を示すため、両者併用による根治が期待されています。実際、抗PD-1抗体と放射線治療の併用療法は世界各国で臨床試験が開始されている状況です。私たちは、放射線照射によりがん細胞膜表面上のPD-L1発現が高まることを見出しました。またその発現上昇には、放射線誘発DNA二本鎖切断により活性化されるATM/ATR/Chk1が必要であることを発見しました。さらにDNA二本鎖切断に対して主要なDNA修復経路因子であるBRCA2とKu70/80が、放射線照射後のPD-L1発現上昇に関わること、さらにその詳細な分子機構を解明し、その研究成果を報告しています(参考論文3, 4)。DNA損傷により免疫抑制に働くPD-L1発現が高まる一方で、T細胞に対して抗原提示を行い免疫を活性化するHLA Class Iの提示も、DNA損傷で高まることを見出し報告しています(参考文献2)。また2023年には、国立がんセンター東病院の秋元先生らの研究グループと共同で、食道がんに対して放射線治療を行った患者さんの検体を用いてシングルセル解析を行った結果、超免疫抑制抑制型のマクロファージや樹状細胞が存在することを見出しました(参考文献1)。この発見は、がん細胞を殲滅するために必要不可欠な免疫を活性化するために重要な知見であると考えています。将来、確実に世界に広がるであろう放射線治療と抗PD-1抗体の併用治療時の分子機構を明らかにしていくことで、放射線免疫併用治療の有用性の証明、併用治療を最大限に活かす治療法の提案をしていきたいと考えています。
参考論文
- Comprehensive single cell analysis demonstrates radiotherapy-induced infiltration of macrophages expressing immunosuppressive genes into tumour in oesophageal squamous cell carcinoma
Science Advances, 2023 - DNA damage promotes HLA class I presentation by stimulating a pioneer round of translation-associated antigen production
Mol Cell, 2022 - Base excision repair regulates PD-L1 expression in cancer cells.
Oncogene, 2019. - DNA double-strand break repair pathway regulates PD-L1 expression in cancer cells.
Nature Communications, 2017 - Inhibition of the HDAC/Suv39/G9a pathway restores the expression of DNA damage-dependent major histocompatibility complex class I-related chain A and B in cancer cells.
Oncology Reports, 2017
プロジェクト3:DNA損傷可視化プロジェクト
~~超高解像度蛍光顕微鏡によって「傷の形」を目で見てみる~~
DNAの傷といっても、その形状は様々です。私たちは、世界最高レベルの超高解像度蛍光顕微鏡を使って、DNA損傷の形を可視化しようとしています。
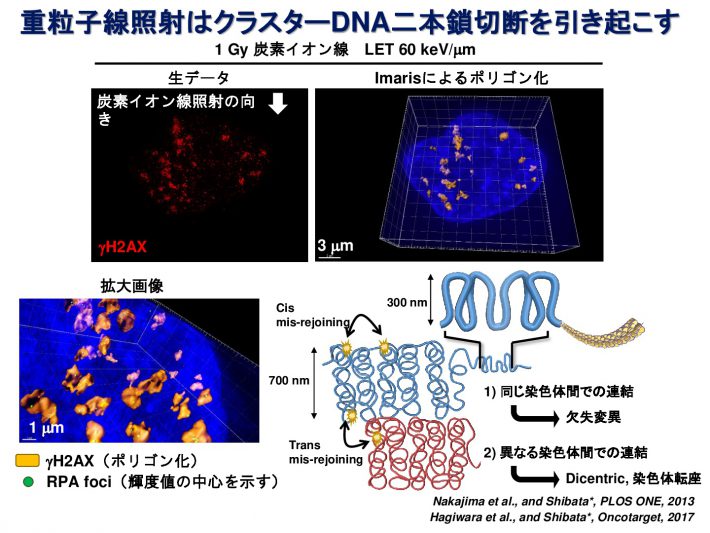
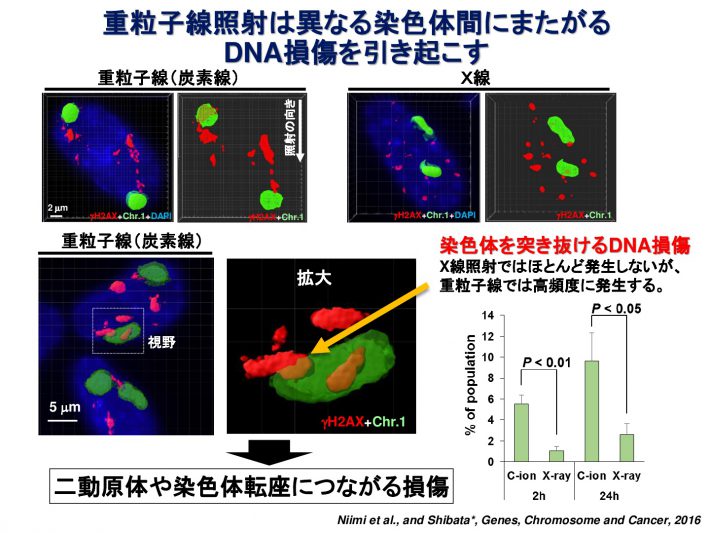
重粒子線は通常のX線とは異なり、非常に複雑な形態のDNA損傷を引き起こすと考えられています。私たちはDNA損傷マーカーであるgH2AXまたは53BP1フォーサイに対して高解像度蛍光顕微鏡で観察することにより、重粒子線照射によって生じたDNA損傷領域が、無数の小さなgH2AXフォーサイを有するクラスターであることを発見しました(参考論文1, 2)。また、重粒子線が染色体間の境界にも高頻度にDNA損傷を引き起こしやすいことを見出し報告しています(参考論文3)。さらに、詳細にDNA損傷部位を同定するため、3次元 構造化照明顕微鏡(Structured Illumination Microscopy;SIM)という方法を用いて、重粒子線照射によって1 μm3の範囲内に、平均700 nmの間隔をもって密集したDSBが生じていることを見出しました(参考論文4)。DNAの傷の形を正確に知ることで、どういった傷が、がん細胞を効果的に殺傷できるのか明らかになると考えています。
参考論文
- Quantitative volumetric analysis of the Golgi apparatus following X-ray irradiation by super-resolution 3D-SIM microscopy.
Medical Molecular Morphology, 2021. - 3D-structured illumination microscopy reveals clustered DNA double-strand break formation in widespread γH2AX foci after high LET heavy-ion particle radiation.
Oncotarget, 2017 - Identification of DNA Double Strand Breaks at Chromosome Boundaries Along the Track of Particle Irradiation.
Genes, Chromosomes and Cancer, 2016. - Visualisation of gH2AX Foci Caused by Heavy Ion Particle Traversal; Distinction between Core Track versus Non-Track Damage
PLOS ONE, 2013 - Identification of DNA Double Strand Breaks at Chromosome Boundaries Along the Track of Particle Irradiation.
Genes, Chromosomes and Cancer, 2016. - Visualization of complex DNA double-strand breaks in a tumor treated with carbon ion radiotherapy
Scientific Reports, 6:22275, 2016. - Identification of DNA Double Strand Breaks at Chromosome Boundaries Along the Track of Particle Irradiation.
Genes, Chromosomes and Cancer, 2016.
実験機器
DeltaVision OMX(超解像イメージング顕微鏡)
実験室
学べること
柴田ラボで学べること
オリジナルの研究教育ストラテジー ILPCの習得
I:Intellectual curiosity(知的好奇心)
L:Logical thinking(論理的思考)
P:Practical experience(実務経験)
C:Communications(国際人としての交流)
柴田研究室では、上記のILPCを軸に世界に羽ばたく若手研究者を育成します!!
ーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーー
1)基本的な生物実験
1.細胞培養
2.プラスミドを使った遺伝子工学
3.PCR
4.ウエスタンブロット
5.フローサイトメトリー
6.蛍光顕微鏡解析
2)今後発展していく最先端の研究技術(これらの技術が使えると、卒業後にその人の「強み」になります!)
1.超高解像イメージング解析
2.ライブイメージング解析
3.次世代シーケンス解析
・RNA-sequence(遺伝子発現解析、トランスクリプトーム解析)
・ATAC-sequence(クロマチン解析)
・ChIP-sequence(エピジェネティック解析)
3)プレゼン発表
1.パワーポイントを使ったスライドの作り方
2.学会などで、人前に出て発表するときのコツ
4)論文の書き方
1.卒論の書き方
2.修論の書き方
3.博士論文の書き方
4.日本語論文の書き方
5.英語論文の書き方
6.トップレベルの雑誌に挑戦するための論文の書き方
5)国際交流(少しずつトレーニングするので、最初は全然できなくても大丈夫です!)
1.英会話
2.英語でのプレゼン
3.海外の人とのコミュニケーション
ーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーー
柴田ラボに入った人は下記のリンクをチェックしておいてください。
入塾したら
大学院生向け
ーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーー
柴田ラボに向いている人
1.実験をやってみたいひと、実験が好きなひと
2.医療を発展させたいひと
3.がん治療を開発・改善したいひと
4.優しいひと
柴田ラボには向かないかもしれない人..
1.有名になるために研究したいひと
2.論文をたくさん出して出世するために研究をしたいひと
3.柴田先生に任せておけばなんとかしてくれるでしょ(ゆるいラボに行きたい)、と思っているひと
大学院生向け
大学院の修士課程・博士課程を目指す学生は、なるべく早いうちに下記のことについて学びましょう。
1)ラボの研究について学ぶ
最初は自分自身のテーマを学ぶだけで精一杯かもしれません。ただ、大学院に入る頃には同僚(先生、先輩、同期、後輩)がどのような研究をしているか理解しておくと良いです。
柴田研究室の代表的な研究成果として、下記の論文については知っておいてください。難しくて理解が追いつかないかもしれませんが、まずはその存在だけでも理解して、少しずつ内容を理解するようにしましょう。
重要!!!『これまでに柴田が行った過去のプレゼン動画を視聴することで、理解を深めましょう。』
→動画視聴はこちら(ラボメンバー限定)
DNA修復経路に関わる代表論文(柴田が責任または筆頭著者)
- G1期細胞における転写共役型DSB修復機構 Yasuhara et al., Cell Rep, 2022
- 転写活性領域における相同組換えの開始機構 Yasuhara et al., Cell, 2018
- G1期細胞におけるDSB修復経路選択機構 Biehs et al., Mol Cell, 2017
- 53BP1脱リン酸化を介した相同組換え環境への移行 Isono et al., Cell Rep, 2017
- MRE11依存的な相同組換え開始機構 Shibata et al., Mol Cell, 2014
- G2期細胞における基本的なDSB修復経路選択ルール Shibata et al., EMBO J, 2011
DNA損傷応答と免疫リガンド発現に関わる代表論文(柴田が責任著者)
- DNA損傷依存的な新規ネオアンチゲン産生経路とHLA Class I提示 Uchihara et al., Mol Cell, 2022
- 塩基除去修復欠損によるPD-L1発現上昇制御機構 Permata et al., Oncogene, 2019
- DSB修復欠損によるPD-L1発現上昇制御機構 Sato et al., Nat Comm, 2017
2)バイオインフォマティクスについて学ぶ
【教育動画を近日アップデートします】
3)論文紹介の選び方
柴田ラボメンバー:修士又は博士学生、または大学院を希望する学部生は、論文紹介では下記の雑誌を中心に選びましょう。
Nature, Nat Cell Biol, NSMB, Nat Comm, Nat Can, Nat Aging
Cell, Mol Cell, Can Cell, Cell Rep, Cell Rep Med
Science, Sci Adv, Science Signal
PNAS, EMBO, NAR, Can Disc, Can Res, JCI
上記以外から選ぶ場合は、なぜその論文が皆に紹介するだけの面白さがあるのか、よく考えてから選びましょう。
4)大学院の志望理由書の書き方(自己アピールの書き方)
入塾したら
柴田研に配属された学部生は、まず最初の数か月で下記の技能と知識を身につけてもらっています。
出来れば最初の一か月で出来るようにしましょう。
1)エクセル
実験データの整理にエクセルは必須です。
例えば得られた実験結果の数値から、合計、平均、標準偏差、1万個の遺伝子の中からの数値の抽出、などをします。このように研究をするためには様々な場面でエクセルの技術が求められます。これらは卒業後に病院・薬局・企業・官庁で働く場面でも、有能な人材として活躍するためには欠かせない技術です。
・【EXCEL関数】必須のよく使うエクセル関数13選!使い方まとめ→こちら
・Excelの基本的な関数一覧┃この12種類は知っておこう!→こちら
修士以上を目指す場合は、「R studio」をインストールしましょう。箱ひげ図や散布図などの特別な図や、そしてインストールの仕方は直接の指導教員に聞いてください。
また、ChatGPTについて知っておきましょう。→こちら
余裕があれば、下記の関数も目を通しておきましょう。
・Excel主要関数79種類を完全解説【保存版】→こちら
(↑なぜYoutubeで無料視聴できるかというほど有用な情報がいっぱいです)
以上を修得した学生には、上級実践編ということでバイオインフォマティクス解析を教えることができます。
2)ワード
卒論・修論・学位論文はもちろん、英語の論文を書くにもワードは必須です。
・Wordの使い方・脱初心者初級編【完全版】→こちら
(↑ワードはこちらの動画一択で良いです)
その他には「校閲」を使えるようにしてください。指導教員とワードファイルの修正などやり取りする際に必須です。下記の赤丸部分を使えるようにしてください。校閲の使い方については、各自でGoogleで調べましょう。
3)パワーポイント
データをまとめてプレゼンすることは研究に必要な技術です。もちろん研究以外でも、様々な職種で必要とされる技術です。卒論・修論・学位論文、そして学会発表で必ず必要となるので、パワーポイントに慣れて素早く図を作れるようにしましょう。
基本の技術は動画にまとめてあります。→こちら(要パスワード)
4)論文検索
PubMedを使って論文を検索できるようにしましょう。→こちら(要パスワード)
5)柴田研の研究を知る
DNA修復チーム、がん免疫チーム、どちらに所属するかにかかわらず、下記の総説を読んで、他の人に説明できるように用語なども覚えておきましょう。その後、自分のテーマに関わる内容についてはオリジナルの英文原著を読みましょう。修士以上を目指す人は必ず該当する柴田研の英文原著を読んでください。柴田ラボには原本(PDFも)がありますので、指導教員に聞いて入手してください。
放射線生物研究 総説 内原 2022
放射線生物研究 総説 内原 2020
放射線生物研究 総説 磯野 2018
放射線生物研究 総説 内原 2013
放射線生物研究のオリジナルHPはこちら
*もし配属前から柴田研に興味がある人がいたら、配属前に勉強しておいてもらうと円滑に研究がスタートできると思います。その場合、「5)柴田研の研究を知る」にある総説を渡すこともできますので柴田までメールください。
6)メールの書き方
意外とメールの書き方を教わる機会は少ないです。そのため、博士号取得者でもとてもビジネスの世界では通用しないようなメール文面を書く方がいます。柴田ラボの卒業生は、病院・薬局、研究、官庁、ビジネス、どの場所においても業界をリードする人材になるために、メールの書き方&ルールを覚えておきましょう。→こちら(要パスワード)
7)日本語論文の書き方
こちらは卒論を書き始めるときに改めて読んでもらいますが、柴田ラボに入ったらまず一通りは目を通しておきましょう。科学用語を使って日本語で文章を書くコツについてまとめてあります。→こちら(要パスワード)