研究成果
2026.1 舘野航平さん(柴田研)の研究成果!!
Esophageal cancer cells exhibit heterogeneity in DNA double-strand break repair and G2/M checkpoint arrest associated with cell viability after ionizing radiation
Advances in Radiation Oncology (ASTRO), 2026
●今回の研究で何を発見したのですか?
食道癌においては、手術と並んで化学療法・
●この研究成果は社会にどんな影響を与えますか?
本研究では、RAD51をはじめとするDNA修復関連タンパクのfoci形成に加え、公共データベースであるCancer Cell Line Encyclopedia(CCLE)を用いて、mRNA遺伝子発現量および遺伝子変異を網羅的に解析しました。これらのデータは、15種類の食道癌細胞株におけるDNA修復関連遺伝子の特徴を体系的に示すものであり、今後、食道癌のDNA修復に着目した研究を進める上で重要な基盤情報になると考えられます。また本研究成果は、RAD51をはじめとするDNA修復因子の発現量を、化学放射線療法の治療効果を予測するバイオマーカーとして臨床応用する際の分子基盤になりうるものと期待されます。
●研究者から一言(舘野):
本研究の立案から実験指導、論文執筆に至るまで、
また、日頃から親身に相談に乗ってくださり、
最後に、このような貴重な機会を与えてくださった佐伯教授、
2025.7 松嵜 健一郎先生(近畿大学)の研究成果!!
Human AAA+ ATPase FIGNL1 suppresses RAD51-mediated ultra-fine bridge formation.
Nucleic Acids Res., 2024
●今回の研究で何を発見したのですか?
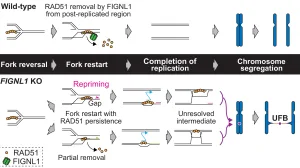
染色体を安定に維持するために必要なRAD51が、染色体上に不適切に蓄積することで、染色体不分離の一種であるUltra-fine bridge(UFB)を引き起こしてしまうことを明らかにしました。また、AAA+ ATPase FIGNL1が、RAD51を適切に除去することで、UFBを抑制していることも明らかにしました。
RAD51は、DNA二本鎖切断(DSB)修復経路の一つである相同組換えの相同鎖検索交換反応を担っています。また、RAD51は、DNA複製で複製フォークが停止した際にフォークの反転、保護を担っており、複製フォークの適切な再開に必要であることが分かっています。このため、RAD51は染色体を安定に維持する上で必須のタンパク質です。一方で、RAD51の機能を抑制するタンパク質群が、これまで様々な生物種で多数報告されてきました。しかしながら、なぜRAD51を抑制しなければならないのか、その原因は不明なままでした。この謎を解くため、RAD51を抑制する機能を持つFIGNL1の欠失細胞を作製し、表現型の解析を行いました。その結果、FIGNL1欠失細胞では、染色体間にUFBが形成していることが分かりました。さらに、このUFBは、複製フォーク再開後に染色体上に残存したRAD51によって引き起こされることも発見しました。今回の結果から、染色体を安定に維持するRAD51が、不適切に染色体上に残っていると、染色体不安定化を促進してしまっている可能性があることが分かりました。
●この研究成果は社会にどんな影響を与えますか?
UFBの増加は、Break-Fusion-Bridge(BFB)サイクルを介して、さらなる染色体不安定化を引き起こします。実際に、FIGNL1欠失細胞では、UFB形成後にDSBが増加することも発見しています。このような染色体の不安定化は、細胞のがん化を引き起こすと考えられます。実際に、いくつかのがん細胞では、RAD51の過剰発現が報告されています。これは、RAD51依存的な染色体不安定化が原因である可能性が考えられます。FIGNL1によるRAD51の除去メカニズムを解析することで、細胞のがん化の初期段階で起きていることを明らかにできると期待しています。
●研究者から一言(松嵜):
染色体を安定に維持する役割を持つRAD51に対して、複数の抑制因子が存在していることが不思議であり、なぜRAD51を抑制しないといけないのか気になっていました。一つ前の論文で、FIGNL1がRAD51を除去する活性を持つことを発見してから、FIGNL1を解析することで、RAD51による染色体不安定化の詳細な分子メカニズムを明らかにできないかと考えていました。解析の結果、DSB修復やDNA複製自体ではなく、染色体分配に影響していることが分かり驚きました。今回の研究は共同研究者の方々のサポートやGDNメンバーの先生方からのアドバイスで実現できました。この場を借りて御礼申し上げます。
2025.7 丹伊田浩行先生(浜松医科大学)の研究成果!!
CARM1/PRMT4 facilitates XPF-ERCC1 heterodimer assembly and maintains nucleotide excision repair activity.
Nucleic Acids Res., 2025,
●今回の研究で何を発見したのですか?
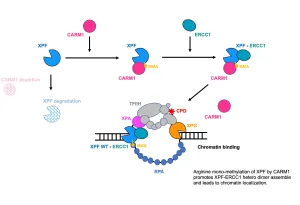
本研究では、nucleotide除去修復(NER)、DNA鎖間架橋修復(ICLR)、DNA二本鎖切断修復(DSBR)、ロングパッチ塩基除去修復(LP-BER)など、多様なDNA損傷修復経路で機能するヌクレアーゼXPF-ERCC1のヘテロ二量体形成に、protein arginine methyltransferaseであるCARM1/PRMT4によるメチル化が必須であることを明らかにしました。
CARM1をsiRNAでノックダウンすると、XPFおよびERCC1の細胞内タンパク質量は減少しましたが、これはmRNA発現の低下ではなく、ヘテロ二量体形成の阻害により、それぞれのタンパク質の安定性が損なわれたためと考えられました。この結果は、CARM1によってメチル化されるXPFのArg568残基をLysに置換した変異体を用いることで裏付けられました。
さらにクライオ電子顕微鏡解析により、Arg568はXPF内の二つのRecAドメインの接触部位に位置していることが示され、このArg残基のメチル化がXPF-ERCC1複合体形成を促進する立体構造変化を引き起こしている可能性が示唆されました。
●この研究成果は社会にどんな影響を与えますか?
XPF-ERCC1は多様なDNA損傷修復に関与する重要なヌクレアーゼであり、その機能不全は発がんを促進する一方で、DNA修復能力の亢進はシスプラチンなどプラチナ製剤に対する薬剤耐性を生じさせることが知られています。
したがって、本研究で示したCARM1によるXPF-ERCC1制御機構は、発がん防御と抗腫瘍化学療法の両面において新たな治療標的となる可能性があります。DNA修復能を適切に制御することで、がん予防だけでなく薬剤耐性克服への応用も期待されます。
●研究者から一言(丹伊田):
私たちは、発がん防御に不可欠な染色体安定性の維持に着目し、研究を進めてきました。近年は特に、最も多様なDNA損傷を修復するNERに関与する細胞内因子の解明に力を注ぎ、Matsunuma MCB 2015、Niida Nat Commun 2017、Nishimoto Mol Cancer Res 2020、Koyauchi BBA-MCR 2022などの成果を報告してきました。
DNA修復研究はメカニズムの解明にとどまらず、他分野との融合によってさらに発展しています。このような革新的な研究を推進するためには、研究者間の協力体制が不可欠です。このGDNは、そのような協力を可能にする最良の研究コミュニティであり、今後もさらなるブレークスルーが生まれることを期待しています。
2025.1 柴田研・奥村光遥(D1・慶應義塾大学)の研究成果!!
●今回の研究で何を発見したのですか?
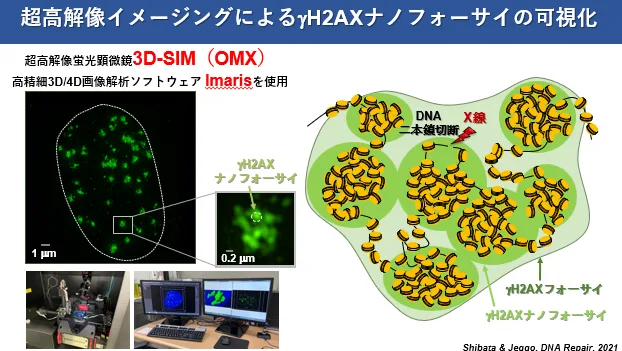
細胞核内に1つのDSBが発生すると、細胞はその単一のDSB末端に対して1-2 MbpにもわたりγH2AXや53BP1などのDNA修復タンパク質を集積させます。近年、超高解像蛍光強顕微鏡を用いた三次元空間イメージング解析により、γH2AXや53BP1は、直径約200 nmのナノドメインが10-20個ほど密集した構造を形成していることが明らかになりました。しかし、このような大規模の修復タンパク質の集積範囲を規定する分子機構やクロマチンナノドメインの形成原理はほとんど明らかになっていません。本研究では、クロマチン構成因子であるMeCP2を欠損させゲノム全体のクロマチン構造を弛緩させた場合、γH2AXのシグナルが広範囲に離散し、γH2AXナノドメインの数が増大することを見出しました。このことから、DSB発生前のクロマチン構造が適切な修復タンパクの集積に影響を及ぼすことが考えられました。
●この研究成果は社会にどんな影響を与えますか?
この発見は、正常なDNA修復タンパクの集積には、その土台となる適正なクロマチン構造が必要不可欠であることを示唆しています。DNA修復タンパクの集積範囲の異常はその後のDNA修復応答を破綻させると考えられることから、修復タンパク質の集積制御に関する本研究は、ゲノム安定化維持機構の理解に繋がるのではないかと思います。
●研究者から一言(奥村):
研究テーマの発案から実験、論文執筆、revision実験、rebuttal letter、そして最後のauthor proofまで、全てをご指導いただきました柴田先生、非常に多くの場面で貴重なご助言をいただきました共同研究の先生方、ラボの皆様のおかげで初めての論文を発表することが出来ました。心より感謝申し上げます。日々のDNA修復研究では、柴田先生の素晴らしいアイデアに感動するとともに、仮説と検証によって生命現象の法則を明らかにすることの面白さを実感しております。これからも一生懸命努力し、DNA修復研究に貢献出来るように頑張りたいと思います。
2024.5 柴田研・奥田賢(D3・慶應義塾大学)の研究成果!!
Exacerbated inflammatory gene expression following impaired G2/M-checkpoint arrest in fibroblasts derived from a patient exhibiting severe adverse effects
Advances in Radiation Oncology. 2024
●今回の研究で何を発見したのですか?
放射線治療の進歩は、標的部位を正確に狙うことを可能にしていますが、その一方で引き起こされる重篤な副作用は依然として重要な問題です。またこれらの副作用の具体的な原因遺伝子はまだ解明されていません。今回の研究では、重篤な消化器障害により治療が中止となった患者様の皮膚細胞にX線を照射し、放射線治療時に生じる予期せぬ重篤な副作用の発生機序ついて解析を行いました。その結果、G2/Mチェックポイントの関連遺伝子が、放射線治療後の重篤な副作用を予見するためのマーカーとなる可能性を見出しました。
●この研究成果は社会にどんな影響を与えますか?
今回の研究成果によって、放射線治療における重篤な副作用を回避するための重要な知見を提供できたと考えております。患者個々に最適な治療法を選択するため、次世代シーケンサーを駆使した遺伝子パネル検査は欠かせません。今後、さらに多くの症例を対象に包括的な解析を行い、有力な候補遺伝子をより明確にすることで、遺伝子パネルを活用した放射線治療の個別化が期待されます。
●研究者から一言(奥田):
今回の研究において、当研究室の柴田淳史先生、患者検体を提供いただいた群馬大学腫瘍放射線学教室の尾池貴洋先生をはじめとする皆様のご指導に心から感謝申し上げます。皆様のご尽力なしには、この成果を得ることはできませんでした。この貴重な経験を糧に、今後も更なる精進を重ねてまいります。
2024.3 柴田研・春名俊志(D2・慶應義塾大学)の研究成果!!
●今回の研究で何を発見したのですか?
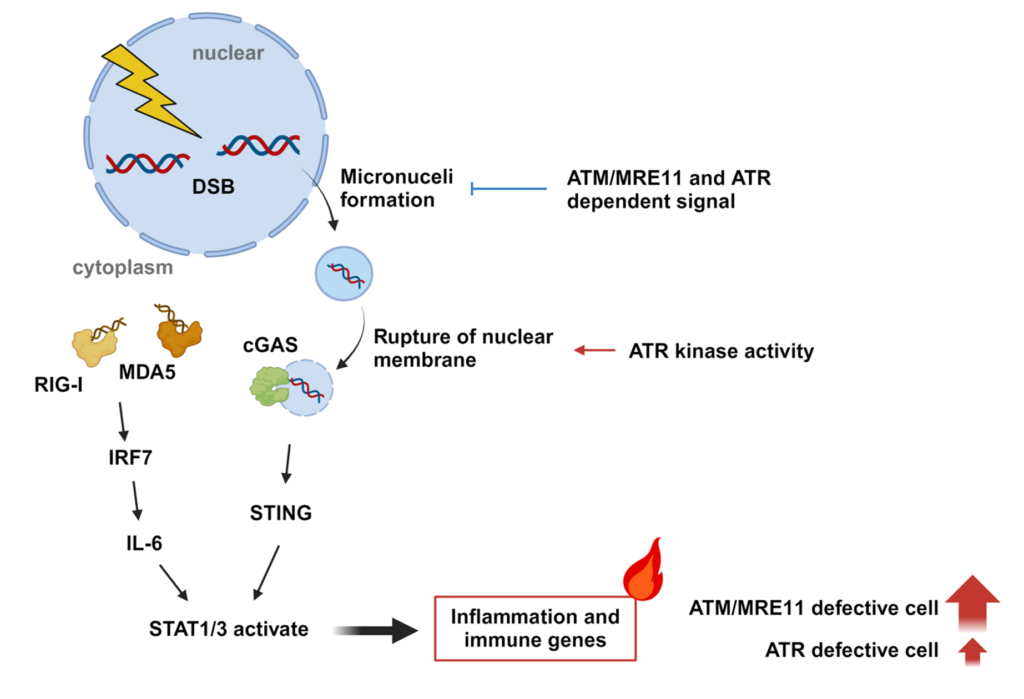
放射線照射によるDNA損傷は、様々な経路を介して、炎症応答を惹起させることが報告されています。その中でも、微小核の形成は、放射線照射後における炎症に深く関わっているとされています。DNA修復の異常は、微小核の形成を介して、炎症応答を促すことが考えられますが、DNA修復遺伝子の欠損と炎症との関連は不明でした。そこで本研究では、種々のDNA修復遺伝子が欠損した患者さん由来の細胞を用いて、X線照射後の微小核の形成数と炎症遺伝子の発現変動について包括的に解析を行いました。その結果、G2/Mチェックポイントに関わるATM/MRE11、ATRが欠損した場合に、X線照射後に微小核の形成が増大し、炎症遺伝子の発現が増大することを見出しました。また、ATM/MRE11が欠損した場合とATRが欠損した場合で遺伝子発現の変動パターンが異なることを見出し、これはSTAT1/3の活性化のバランスが異なることが要因であると考えられました。
●この研究成果は社会にどんな影響を与えますか?
放射線治療において、正常組織の有害事象の最小化は重要な課題です。本研究により、G2/Mチェックポイントの停止に必要なATMやMRE11、ATRが欠損した場合に、過剰な炎症応答を引き起こすことを見出しました。こうした発見は、有害事象の予測に役立つと考えております。一方で、がん細胞における過剰な炎症応答は、抗腫瘍免疫の活性化という点で有用であると考えられます。したがって、本研究成果で見出した結果を踏まえて、免疫療法の効果を高める治療法の開発も期待されます。
●研究者から一言(春名):
昨年度から柴田先生が着任され、研究テーマが変更になりましたが、柴田先生、加藤先生のご指導のおかげで論文を出すことができました。これまで、ウェットの実験を中心に研究を行ってきましたが、この論文を通して、ドライ解析の技術(RNA-seq)を習得することができました。現在は、シングルセル解析技術の習得を目指し、日々努力しております。
2024.3 柴田研・林僚汰(M1・慶應義塾大学)の研究成果!!
●今回の研究で何を発見したのですか?
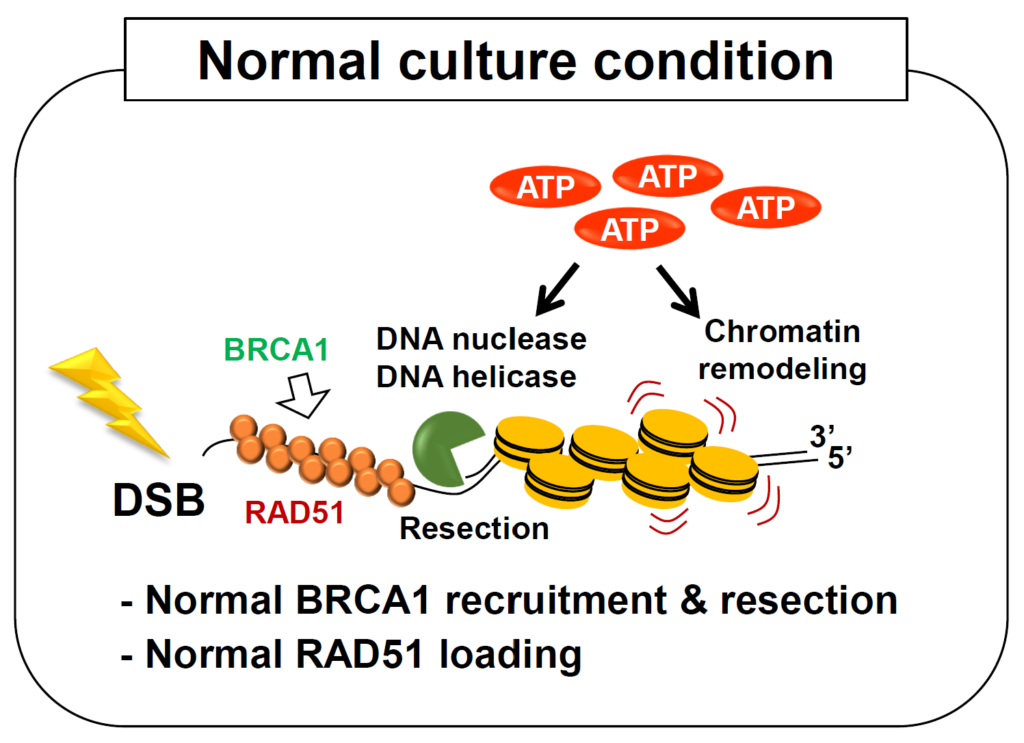
DNA二本鎖切断(DSB)の修復でおこなわれるDSB末端のプロセシングやDNAリガーゼによる連結反応、そしてDSB近傍のクロマチン構造の変化にはいくつものリン酸化酵素が関わっており、多くのATPが消費されると考えられています。しかしながら、これまでDSB修復におけるATPの必要性については研究がほとんど行われておりませんでした。今回の研究では、ATP合成阻害剤を用いて培養細胞内のATP濃度を通常時の20%まで低下させる
ことで、53BP1やBRCA1、RPA、RAD51といった修復タンパク質のDSB部位への集積が低下することを見出しました。これらの結果から、DSB修復を担ういくつかの経路のうち、正確な修復を行うことで知られている相同組換えが低ATP環境下で活性が抑制されていることが示唆されます。(by 林)
●この研究成果は社会にどんな影響を与えますか?
これまでDSB修復に関わるタンパク質において、一つのタンパク質のリン酸化活性やATPase活性にフォーカスを当て、機能を報告した論文は数多くありますが、ATPが低下した状態で俯瞰的にDSB修復機構への影響について報告した論文はありませんでした。今回の低ATP環境下におけるDSB修復能の解析により、ATPが低下した状態では相同組換え修復の活性が低下することが示唆されました。虚血症、心筋梗塞などによる低酸素状態、
糖原病、ミトコンドリア病ではATPが正常に産生されないことが報告されており、DSBが生じた際に正確な修復が行われず、ゲノム異常が生じてしまうことが考えられます。そのためDSB修復とATPの関係を明らかにすることは非常に重要なポイントであり、現在は低ATP条件下におけるDSB修復についてさらなる知見を深めることを目標に研究を進めております。(by 林)
●研究者から一言(林):
大学の卒業研究として始めたテーマが発展し、このたび論文として発表することができたことは非常にうれしく思います。まだ若輩者の私が研究成果を出すことができましたのは、日ごろから親身になって私を教育してくださる柴田先生をはじめ多くの先生方のご指導ご協力のおかげです。この場を借りて先生方に心より御礼申し上げます。少しでも早く一人前の研究者となれるよう今後も日々精進致します。
2023.12 柴田(慶應義塾大学)の研究成果!!
●今回の研究で何を発見したのですか?
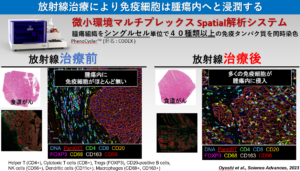
放射線治療前後の食道がん患者さんの組織を、1細胞解析、空間的トランスクリプトーム解析等を用いた時空間解析を行い、これまで不明な点が多かった放射線治療によるがん免疫応答のメカニズムを空間、細胞、遺伝子単位で明らかにしました。本研究により、放射線治療と併用することで治療効果が期待できる標的細胞、遺伝子、併用タイミング等の重要な情報を得ることできました。特に放射線治療中に増加した PD-L1、IDO1、SIRPA等の免疫抑制遺伝子を強く発現するマクロファージは重要な役割を担っていると予測され、本研究で見いだされた免疫細胞や遺伝子を標的にした治療法を検証していくことで、食道がんに対する有効な治療法の開発が期待できます。
●この研究成果は社会にどんな影響を与えますか?
現在、放射線治療、化学療法、外科手術、免疫治療、様々な治療方法があり、それぞれの治療方法はその技術革新により劇的に治療成績が向上しています。実際の臨床ではそれぞれ一つ一つの治療方法を単独で行うことはほとんど無く、全ての治療を組み合わせた集学的がん治療が行われています。特に、化学療法と放射線治療を組み合わせた『化学放射線治療』と『免疫治療』は同時期に用いられることが多いです。しかしながら、がん細胞にDNA損傷を誘発してがん細胞を殺傷する化学放射線治療を行った後で、がん周辺の免疫環境がどのようになっているかは長い間不明でした。本研究では、実際の人の患者さんの検体を解析することで、放射線治療後に一部の細胞では免疫が活性化し、また一部の免疫細胞は疲弊してしまうことを空間、細胞、遺伝子単位で明らかにしました。本研究で見いだされた免疫細胞や遺伝子を標的にした治療法を検証していくことで、食道がんに対する有効な治療法の開発が期待できます。
●研究者から一言(柴田):
今回、国立がん研究センター東で行われたがん治療患者さん由来の検体を用いて、シングルセル次世代シーケンス解析や1細胞イメージングなどの最先端技術を駆使することで、放射線治療後には腫瘍微小環境内に免疫抑制系のマクロファージが生じていることを証明しました。現在は、本研究による発見をもとに、免疫抑制型のマクロファージを標的とした新しいがん治療法の開発を目指した研究に着手しています。この度は、共同研究の機会をいただいた国立がん研究センター東の秋元哲夫先生、同センターの影山先生・大吉先生、東京大学の鈴木穣先生、そして貴重な臨床検体を提供いただいた方々に深く感謝申し上げます。
2022.7 松嵜(近畿大学)の研究成果!!
●今回の研究で何を発見したのですか?
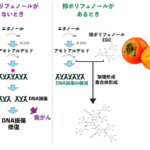
アセトアルデヒドは、エタノールの代謝産物であり、飲酒の際などに体内に蓄積します。アセトアルデヒドは、飲酒の際に酒酔い(二日酔い)を引き起こし、長期的にはDNAを傷つけることでがんの原因にもなっています。アセトアルデヒドがDNA損傷を引き起こすことは分かりはじめてきたものの、どのような種類のDNA損傷が引き起こされるのか、そしてアセトアルデヒドによるDNA損傷に対して細胞がどのように応答しているのかについては、不明な点が多く残されていました。今回の研究で、アセトアルデヒドがDNA二重鎖切断(DSB)を引き起こすこと、そして非相同末端結合と相同組換えの二つの経路によって修復されることを発見しました。さらに、私達は、柿由来のポリフェノールがアセトアルデヒドによるDNA損傷を抑制することを発見しました。柿は、甘柿と渋柿に大別され、その渋味は豊富に含まれているポリフェノール(タンニン)に起因します。渋柿を食べるためには、渋抜きをする必要があり、一般的にアルコールが利用されています。その原理は、柿の中にアセトアルデヒドを生じさせ、アセトアルデヒドが可溶性の柿ポリフェノールを重合し不溶性にすることで、渋味を取り除くというものです。この柿ポリフェノールの性質を利用し、アセトアルデヒドによるDNA損傷を低減できるか検討したところ、柿ポリフェノールとその構成成分であるエピガロカテキン(EGC)がアセトアルデヒドを吸着し、DNA損傷を抑制することを発見しました。これらの結果は、飲酒の際に柿ポリフェノールを摂取することで、飲酒による発がんのリスクや酒酔いを防げる可能性を示しています。
●この研究成果は社会にどんな影響を与えますか?
アセトアルデヒドに対する細胞の応答システムの研究は、飲酒による発がんや酒酔いを抑える方法の開発へつながる研究です。飲酒などにより摂取されたエタノールは体内でアセトアルデヒドに代謝されます。アセトアルデヒドは、代謝酵素であるアルデヒド脱水素酵素(ALDH2)により、無害な酢酸に代謝されます。しかし、日本を含む東南アジアでは、ALDH2に変異を持つ人が40%ほどおり、飲酒の際にアセトアルデヒドが蓄積し、酒酔い状態になりやすいことが知られています。さらにこの変異を持つ人では、アセトアルデヒドの蓄積による発がんリスクの上昇が見られます。このため、アセトアルデヒドに対する応答システムの理解と、その抑制方法の開発は、世界的にも多くの人の生活を改善できる可能性を秘めた研究であると考えています。
●研究者から一言( 松嵜):DNA損傷は、日常的に私達に生活で起きるものなので、DNA損傷が生じるメカニズムの理解を通して、より身近で安全な方法により、そのリスクを軽減できればと考えながら研究を行っています。また、生まれ持った遺伝的性質により、同じ生活を送っていても、病気のリスクが異なることがあります。そのような状況の原因を理解して、遺伝的性質の差を無くすような技術を開発することで、家系や人種でのデメリットをなくせるようにできたらと思っています。今回の研究で協力していただいた方々には、とても感謝をしております。
2022.6 安原(東京大学)の研究成果!!
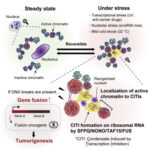
●今回の研究で何を発見したのですか?
私たちの体の細胞は常に外部から様々なストレスを受けており、それらに適切に応答できないと、がんなどの病気の原因となります。がん細胞がもつ異常なDNAの中でも「遺伝子融合」は、機能が著しく変化した異常なタンパク質の生成を伴って、がんの発生や進展、病態に深く関わっていることが知られています。染色体転座が発生するためには、複数のDNA切断末端同士が空間的に近づいていることが必要ですが、遺伝子融合のような染色体転座がどのようにして起きるかは詳しくわかっていませんでした。
今回の研究で、細胞に紫外線や抗がん剤処理、低温刺激などをすると、SFPQやNONOと呼ばれるパラスペックルを構成するタンパク質が核小体のリボソームRNA上に集まり、液―液相分離のような性質をもつ凝集体を可逆的に形成することを発見しました。SFPQやNONOは定常状態では転写が活性化している遺伝子領域に結合していますが、ストレス誘導下で凝集体を形成している際にも遺伝子領域に結合したままであり、つまり活性化遺伝子領域が凝集体に巻き込まれて核小体周辺に移動してしまうことがわかりました。さらに、凝集体によって複数の遺伝子領域を近接した場合には、それらの間での遺伝子融合のリスクが高まっていることが確かめられました。従って、ストレス誘導性の凝集体は、活発に転写されている遺伝子領域を核小体周辺に集合させることで遺伝子融合のリスクを高めており、細胞が受ける様々なストレスが、がん化をもたらすメカニズムの一つであると考えられました。
●この研究成果は社会にどんな影響を与えますか?
以前の私たちの研究では、正確なDNA修復を通して染色体転座を抑制する経路が何かという点に着目し、転写共役型相同組換え修復(TA-HRR)と転写共役型末端結合(TA-EJ)という2つの新しい経路を発見しました。これに加えて今回は、染色体転座を引き起こしうる染色体同士を近接させるメカニズムを解明することができました。今後は、最後の課題である「そもそもDNA切断がどうして起こるのか」というところを明らかにしていきたいと思います。将来的には、疾患につながるようなゲノム異常の誘導機構の解明を通して、様々な病気の原因の解明、予防、治療する方法の開発へと進めていきたいです。
●研究者から一言(安原):凝集体の形成を顕微鏡下で発見した瞬間は今でも鮮明に覚えています。細胞内にはまだまだ不思議な現象がたくさん隠れていると思うので、一つでも多くそのような瞬間を捉えられるよう、研究を進めていきたいと思います。
2022.5 柴田・内原(群馬大学)の研究成果!!
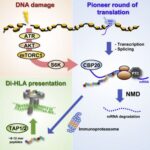
●今回の研究で何を発見したのですか?
抗原提示を行うことで免疫を活性化する役割を持つHLA Class Iが放射線照射によって活性化されることは知られていましたが、その分子メカニズムはこれまで不明でした。今回の研究により、放射線そのものがHLA Class Iを活性化させるというよりも、放射線によって引き起こされるDNA損傷が、細胞内のシグナル伝達を活性化してHLA Class Iの細胞膜提示を上昇させることを明らかにしました。我々はDNA損傷によって誘導されるHLA Class Iの提示を「DNA damage-induced HLA (di-HLA)提示」と名付けました。そして様々な解析から、DNA損傷はATR, AKT, mTORC1を介してパイオニアラウンド翻訳を活性化し、抗原の源となるペプチドを産生しているのではないかということを突き止めました。(詳細はプレスリリースをご参照ください)
●この研究成果は社会にどんな影響を与えますか?
がん治療において、放射線治療を筆頭に、シスプラチンなどの多くの化学療法剤は、癌細胞にDNA損傷を引き起こすことで癌細胞を殺傷します。一方で、DNA損傷系の癌治療がDNA損傷だけではなく患者の免疫活性化を介して癌治療を殺傷する可能性が報告されていますが、その詳細は未だ多くが明らかになっていません。本研究では、DNA損傷を使ったがん治療時の重要な免疫応答の一つであるHLA Class Iの抗原提示の分子メカニズムを明らかにすることができました。これらの分子メカニズムを一つ一つ明らかにすることで、DNA損傷誘導系のがん治療と、免疫治療を合わせた新しいがん治療法の開発が期待されます。また一方で、異常なHLA Class Iの活性化は慢性炎症・自己免疫疾患・アレルギー疾患にも関わることから、これらの疾患に関しても、今回明らかにした分子メカニズムを標的とした新しい予防法・治療法の開発が期待されます。

●研究者から一言(柴田):DNA損傷は体内の様々な場面で生じています。細胞はその傷を直そうとすると同時に、体中に傷ついた細胞がいることを伝える機能があります。その一つの反応として、HLA Class Iを使った抗原提示の応答があったのですが、長くその分子機構は分かっていませんでした。科学の世界では、「技術の進捗」と「斬新なアイディア」、この二つが両輪のように循環しながら新しい知見を生み出します。今回はまさにそのケースで、新しい分子生物学的実験技術の発達、特に次世代シーケンスを駆使したデータ解析、そして私たちのDNA修復の知識や経験から生まれたアイディアにより、非常に難解だった抗原産生のメカニズムを明らかにすることができました。この研究成果が、DNA損傷、免疫、炎症が関わる医療の発展に繋がればと願っております。また今回の研究は多くの共同研究者に支えられることで実現しました。この場を借りて深く御礼申し上げます。

●研究者から一言(内原):今回の研究では、DNA損傷や免疫、翻訳などの幅広い専門分野の知識やデータ解析技術が必要とされたため、自分一人の能力では解決困難な様々な難題にぶつかりました。しかし、多くの先生方にサポートしていただいたおかげで、無事に乗り越えることができ、興味深い発見をすることができました。研究者として成長できたのも、論文として成果をまとめることができたのも多大なご支援なしには実現できなかったと思います。この場を借りて共同研究者の先生方に深く感謝いたします。
2022.2 安原・加藤(東京大学)、柴田・内原(群馬大学)の共同研究成果!!
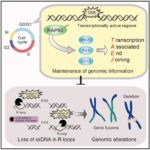
●今回の研究で何を発見したのですか?これまでの私たちの研究から、放射線照射などによってDNAが切断された際、その近傍でDNAとRNAから成るR-loopと呼ばれる構造が生じることが分かっていました(Yasuhara et al., Cell, 2018)。R-loop構造は一般的に不安定な構造なのですが、不思議と細胞はその構造をきちんと維持しながら、R-loop構造を巧みに利用し次の修復ステップに進んでいることも分かっていました。しかし細胞がどのような仕組みでR-loop構造を安全に維持しているかは分かっていませんでした。今回の私たちの研究で、RAP80がR-loop構造の維持に重要な役割を果たしていることが分かりました。RAP80が欠損した細胞では、R-loop構造が崩壊し、修復経路に異常が生じ、結果として欠失変異や染色体転座が起きてしまうことが分かりました。以上のことから、RAP80によりR-loop構造が安全に保たれることは、細胞がDNAを正しく修復するために重要なステップであることが分かりました。
●この研究成果は社会にどんな影響を与えますか?私たちの体の中にあるDNAは、日々の生活の中で、ストレス・放射線/紫外線・化学物質により傷ついています。しかし人の体にはDNAを修復する機能があり、DNAを元の状態に復元することができます。DNA修復反応が誤って起こってしまうと、がんを含めた様々な病気の発症リスクが高まります。この数十年の研究から、DNA修復反応はとても複雑な分子間ネットワークを使っていることが分かってきています。そのため、その全貌を理解することは本当に大きなチャレンジだと思っていますが、一つ一つ謎を紐解いていくことが重要です。今回の研究では、DNA修復反応時に生じるR-loopを安全に維持することが重要であると証明しました。DNA(遺伝子)を安全に守り、正確に修復することが、維持に必要不可欠です。今回の発見は、がんや遺伝病の予防を実現する新しい方法の提案に繋がると思っています。

●研究者から一言(柴田):今回の論文は2012年頃からのスタートでしたので、約10年かかっています。共著者の方々はもちろんのこと、関係者のサポートにより本研究成果を発表できたことをとても感謝致します。特に英国サセックス大学のPenny Jeggo教授には研究についていつも相談させていただき大変感謝申し上げます。Pennyは僕に教えているつもりはないかもしれませんが、色々と教わっていますので、これからも努力を絶やさず、Pennyのような世界のDNA修復分野をリードする研究者を目指したいと思います。

●研究者から一言(加藤):ご指導してくださった先生方や共同研究の先生方に追いつけるように、研究を続けて日々精進していきたいと思います。
2021.10 勝木(京都大学)の研究成果!!
●今回の研究で何を発見したのですか?
ファンコニ貧血(FA)は造血不全や奇形、好発がん性が特徴の重篤な遺伝病で、DNAクロスリンク修復に必須の遺伝子群の変異によって発症します。今回の研究では、FA原因遺伝子SLX4/FANCPの修復機能を制御する分子をスクリーニングで探索しました。SLX4の損傷部位へのリクルートに必要な、ユビキチン結合ドメイン(UBZ4)を含むN末端アミノ酸配列とsiRNAライブラリーを用い、E3ユビキチンリガーゼRNF8, RNF168をかいしたユビキチンシグナル経路が重要であることをあきらかにしました。
●この研究成果は社会にどんな影響を与えますか?
SLX4はこれまで、canonicalなFA経路の下流でモノユビキチン化FANCD2によってリクルートされるとのモデルが根強く支持されてきました。今回の成果で、RNF8, RNF168依存的にユビキチン化される基質や、未知のユビキチン化経路が介在する可能性が示され、造血系を守るあらたな分子メカニズムを提唱しました。
2020.6 香崎(産業医大)の研究成果!!
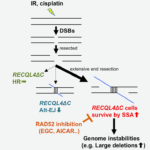
●今回の研究で何を発見したのですか?
希少疾患RTS(Rothmund-Thomson Syndrome)
●この研究成果は社会にどんな影響を与えますか?
DNA修復エラーが大きいSSA経路だけが特異的に亢進するがん